안녕하세요.
2022년 5월 10일에 「의약외품 품목허가·신고·심사 규정」 개정고시가 있어서 공유드립니다.
식품의약품안전처 고시 제 2022-37호 입니다.
개정이유는 아래와 같구요.

주요 변경내용
가. 의약외품 외용소독제 중 벤잘코늄염화물 함유 제품의 용법·용량에 뿌려서 사용하는 방식을 기재할 수 없도록 개정(안 제13조제7호, 별표 1)
제13조(용법․용량)
7. 「의약외품 범위 지정」 제2호다목에 해당하는 에어로솔제는 원칙적으로 자동분사(유효성분을 함유하는 원액을 일정 시간 간격으로 일정량씩 자동으로 계속 분사) 방식으로 사용하도록 기재할 수 없으며, 「의약외품 범위 지정」(식품의약품안전처 고시) 제2호바목에 해당하는 외용 소독제(벤잘코늄염화물에 한함)는 뿌려서(분무 또는 스프레이)사용하도록 기재할 수 없다.
나. 의약외품 외용소독제 중 마개달린 파우치 또는 포 형태의 직접 용기 사용 시 200밀리리터를 초과한 포장단위로 기재하도록 하여 식품과 유사한 포장 형태로 인한 식품 오인 등 방지(안 제15조제3항·4항)
제15조(포장단위)
③ 「의약외품 범위 지정」(식품의약품안전처 고시) 제2호바목에 해당하는 의약외품은 200밀리리터를 초과한 포장단위로 기재하여야 한다.(단, 마개달린 파우치 또는 포 형태의 직접용기를 사용하는 경우에 한함)
* 2호바목: 바. 인체에 직접 사용하는 과산화수소수, 이소프로필 알코올, 염화벤잘코늄, 크레졸 또는 에탄올을 주성분으로 하는 외용 소독제
④ 제2항 및 제3항에 해당하지 아니하는 의약외품의 포장단위는 제조의 경우 “자사포장단위”, 수입의 경우는 “제조원 포장단위”로 기재한다.
<참고로, 2021년 8월 1일 부터 외용소독제에 마개 달린 소용량 파우치 용기‧포장 제한이 시작되었습니다.>

다. 출산 직후 출혈 및 오로(산후 질 분비물)의 위생처리를 목적으로 사용하는 물품이 의약외품으로 추가 지정(시행일: `21.10.1.)되어, 안전성유효성 심사자료 제출범위 규정(안 제21조, 별표 3)
제21조(안전성·유효성 심사대상)
[별표 3]
안전성․유효성 심사자료 제출범위(제24조제1항 관련)
Ⅰ. 「의약외품 범위 지정」(식품의약품안전처고시) 제1호, 제4호바목에 해당하는 의약외품
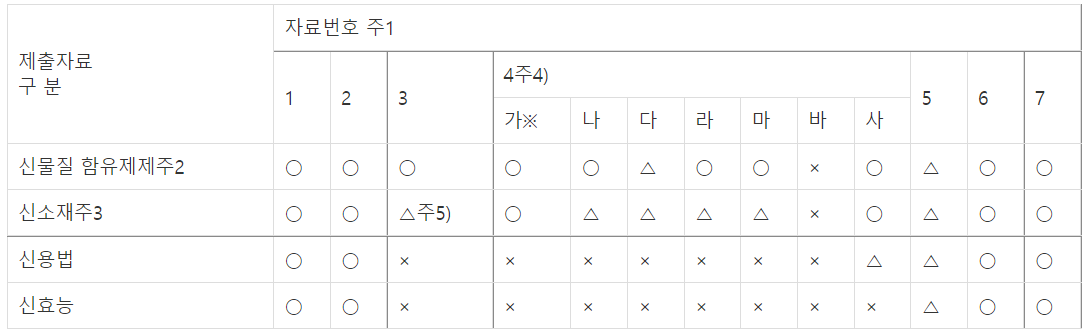
○ : 자료를 제출하여야 하는 것
△ : 개개 품목에 따라 판단하여 제출하는 것이 무의미하거나 불가능하여 면제할 수 있는 것
× : 자료가 면제되는 것
주1 : 자료번호 1부터 7까지는 제23조제1호부터 제7호까지의 자료를 말한다. 다만 독성에 관한 자료(4) 중 ※는 단회투여독성시험자료 또는 세포독성시험자료로 한다.
- 자료1: 기원 또는 발견 및 개발경위에 관한 자료
- 자료2: 기준 및 시험방법에 관한 자료
- 자료3: 안정성에 관한 자료(장기보존시험자료 또는 가속시험자료)
- 자료4: 독성에 관한 자료
가. 단회투여독성시험자료
나. 반복투여독성시험자료
다. 생식․발생독성시험자료
라. 유전독성시험자료
마. 면역독성시험자료(피부감작성시험자료 포함)
바. 발암성시험자료
사. 국소독성시험자료
아. 의존성시험자료
- 자료5: 효능․효과를 입증할 수 있는 자료
- 자료6: 외국의 사용현황에 관한 자료
- 자료7: 국내 유사제품과의 비교검토 등 그 밖의 특성에 관한 자료
라. 신물질 함유 의약외품의 품목허가 신청 후 민원처리 담당자와 직접 대면하거나 화상을 통하여 상담받을 수 있는 제도 신설 (안 제52조의1)
제52조의1(화상회의 등) ① 식품의약품안전처장은 「약사법」제31조 또는 제42조에 따라 신물질 함유 의약외품의 품목허가를 신청한 자가 다음 각 호의 어느 하나에 해당하는 회의의 개최를 요청하는 경우 민원처리기한에 영향을 미치지 않는 범위 내에서 회의를 개최하고, 그 결과를 회의일로부터 10일 이내에 신청인에게 통지하여야 한다.
1. 개시회의: 제품의 개발경위 등 허가ㆍ심사 시 고려해야 할 사항 등에 대해 설명이 필요한 경우
2. 보완설명회의: 보완요구 자료의 종류, 범위, 요건 등에 대한 사유 및 근거 등에 대해 설명이 필요한 경우
3. 추가 보완회의: 보완요구 제출자료에 대해 추가 설명이 필요하거나 재보완 요구자료에 대한 설명이 필요한 경우
② 제1항에 따른 회의는 화상을 이용하거나 대면(對面)에 의한 방법으로 할 수 있다.
* 표시기재 내용이 연계되어 있어서, 「의약외품 표시에 관한 규정」도 같은날 함께 개정고시 되었습니다.
(이 내용은, 다음 글에서 이어서 설명 하려구요.)
부칙 및 경과조치 관련
부칙<제2022-37호, 2022. 5. 10.>
제1조(시행일) 이 고시는 고시한 날부터 시행한다.
제2조(적용례) 이 고시는 시행일 이후 최초로 식품의약품안전처장 또는 지방식품의약품안전청장에게 의약외품 제조판매ㆍ수입품목 허가(변경허가를 포함한다)를 신청하거나 신고(변경신고를 포함한다)하는 것부터 적용한다. 다만, 제15조의 개정규정은 이 고시 시행 전에 종전의 규정에 따라 의약외품 제조판매ㆍ수입품목 허가(변경허가를 포함한다)를 신청하거나 신고(변경신고를 포함한다)한 경우에도 적용할 수 있다.
제3조(포장단위에 관한 경과조치) 이 고시 시행 당시 종전의 규정에 따라 품목신고하거나 품목허가를 받은 경우에는 이 고시 시행일 이후 6개월이 경과한 날까지 제15조의 개정 규정에 적합하도록 하여야 한다.
'의약외품 정보 > 법규 및 기준 고시' 카테고리의 다른 글
| KQC 일부개정고시 (2022-45) (1) | 2022.06.24 |
|---|---|
| 의약외품 표시에 관한 규정 개정 고시 (1) | 2022.05.24 |


댓글